干货 | WB 实验中的关键控制点和注意事项
满怀期待跑 WB,拍照后却发愁了,条带怎么这么弱?这种时候,相信很多小伙伴都百思不得其解,除了发问“条带去哪了”,还一度相信 WB 就是门玄学。长此以往,大家面对 WB 实验似乎都抱有“心诚则灵”的无力态度,万一成功了呢?
玩笑归玩笑,言归正传,面对不好拿下的 WB 实验,“心诚则灵”是有道理的。“心诚”的意思是,面对失败的实验jnh官网有必要用心逐一排查问题所在,优化实验体系。总而言之在繁琐复杂的 WB 面前,没有任何捷径。
本期的干货课堂jnh官网就来重点探讨 WB 实验中的一些关键控制点,并提供实用的 Tips 供大家参考。
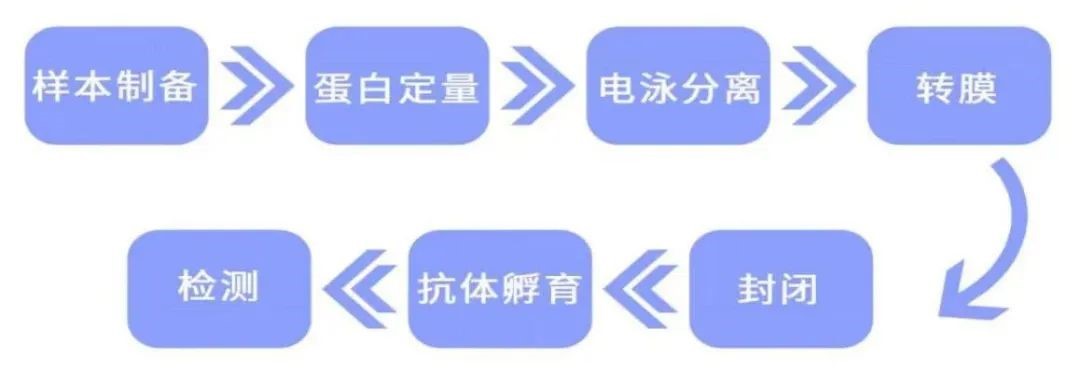
WB 实验步骤
WB 实验中的关键控制点和注意事项
Key Points about WB
一
WB 样本的制备
将样品置于冰上或者维持在 4℃ 下
选择合适的抑制剂
抑制剂推荐
蛋白酶抑制剂
在细胞破裂蛋白抽提的过程中,这些蛋白酶也会被一起释放出来,混入蛋白样品中,对蛋白样品造成降解
磷酸酶抑制剂
*(检测磷酸化条带时必须要添加)
磷酸酶机理:通过水解磷酸单酯将底物分子上的磷酸基团除去,并生成磷酸根离子和自由的羟基
二
选择合适的蛋白定量方法
进行 Bradford 分析、Lowry 分析或二喹啉甲酸 (BCA) 分析
通常使用牛血清蛋白 (BSA) 作为蛋白质标准品
三
WB 电泳分离
用还原及变性的缓冲液 (e.g. Laemmli buffer)将蛋白变性,准备上样
使多肽带上负电荷
使蛋白变性并将多肽拉直
将二硫键打断
使抗原表位暴露出来
凝胶上样
20-40 µg 全细胞裂解液或 100 ng 纯化蛋白
每条泳道上相同蛋白量
根据目标蛋白的表达量优化上样量
分离胶选择 Tips(FuturePAGE蛋白预制胶)
分子量 4-40 kDa,分离胶浓度 20%
分子量 12-45 kDa,分离胶浓度 15%
分子量 10-70 kDa,分离胶浓度 12.5%
分子量 15-100 kDa,分离胶浓度 10%
分子量 25-200 kDa,分离胶浓度 8%
四
WB 的蛋白转膜
电泳结束后,凝胶(带有已分离的蛋白)与膜紧贴放置,使用电流把蛋白从凝胶转到膜上。转膜结束后可用丽春红进行可逆转色判断转移效果。
膜的类型
硝酸纤维素膜(NC 膜),韧性差,低背景
Polyvinylidene Difluoride (PVDF 膜转印包),甲醇激活,蛋白结合力强
转膜 Tips
对于分子量较大的靶蛋白,推荐在转膜缓冲液中加入 SDS 至终浓度为 0.1%;对于分子量较大的靶蛋白,推荐在转膜缓冲液中使用 10% 或者更低浓度的甲醇;对于分子量较小的靶蛋白,推荐在转膜缓冲液中使用 20% 甲醇
对于分子量较大的靶标蛋白,建议使用 0.45 μm 的 PVDF 膜;对于分子量较小的靶标蛋白,建议使用 0.22 μm 的 PVDF 膜
五
WB 的封闭处理
膜封闭处理可降低一抗/二抗的非特异性结合。
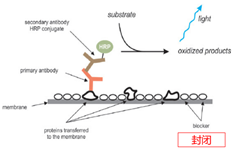
常用的封闭剂
5% 脱脂奶粉 in TBST
5% BSA in TBST
六
抗体孵育
一抗特异性地检测目标蛋白
一抗室温孵育 1-2 h 或 4 ℃ 过夜孵育
选用适合的一抗工作浓度或稀释度
一抗可以用封闭液来稀释
WB 信
二抗辨认一抗的恒定区
(具有物种特异性)
二抗室温孵育 1-2 h
选用适合的二抗工作浓度或稀释度,一般工作浓度要低于一抗
二抗可以用封闭液来稀释
二抗带有标签
七
WB 的信号检测
检测方法分为化学发光检测和荧光检测。
号检



